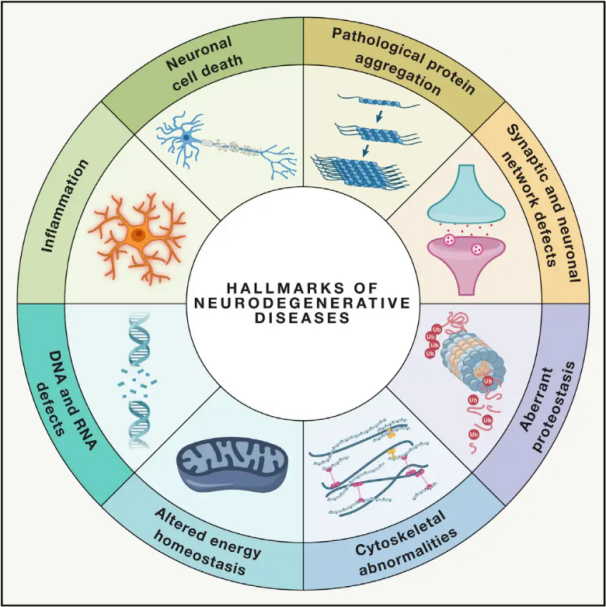
Neurodegeneratieve ziektenNeurodegeneratieve aandoeningen (NDD's) worden gekenmerkt door het progressieve of aanhoudende verlies van specifieke kwetsbare neuronale populaties in de hersenen of het ruggenmerg. De classificatie van NDD's kan gebaseerd zijn op verschillende criteria, waaronder de anatomische verspreiding van neurodegeneratie (zoals extrapiramidale stoornissen, frontotemporale degeneratie of spinocerebellaire ataxie), primaire moleculaire afwijkingen (zoals amyloïde-β, prionen, tau of α-synucleïne) of belangrijke klinische kenmerken (zoals de ziekte van Parkinson, amyotrofische laterale sclerose en dementie). Ondanks deze verschillen in classificatie en symptoompresentatie delen aandoeningen zoals de ziekte van Parkinson (PD), amyotrofische laterale sclerose (ALS) en de ziekte van Alzheimer (AD) gemeenschappelijke onderliggende processen die leiden tot neuronale disfunctie en uiteindelijk celdood.
Met miljoenen mensen wereldwijd die getroffen zijn door neurodegeneratieve aandoeningen (NDD's), schat de Wereldgezondheidsorganisatie dat deze ziekten tegen 2040 de tweede belangrijkste doodsoorzaak zullen zijn in ontwikkelde landen. Hoewel er verschillende behandelingen beschikbaar zijn om de symptomen van specifieke aandoeningen te verlichten en te beheersen, blijven effectieve methoden om de progressie van deze aandoeningen te vertragen of te genezen moeilijk te vinden. Recente studies wijzen op een verschuiving in behandelingsparadigma's van louter symptomatische behandeling naar het benutten van celbeschermende mechanismen om verdere achteruitgang te voorkomen. Uitgebreid bewijs suggereert dat oxidatieve stress en ontsteking een cruciale rol spelen bij neurodegeneratie, waardoor deze mechanismen belangrijke doelwitten zijn voor cellulaire bescherming. De afgelopen jaren heeft fundamenteel en klinisch onderzoek het potentieel van hyperbare zuurstoftherapie (HBOT) bij de behandeling van neurodegeneratieve aandoeningen aangetoond.
Inzicht in hyperbare zuurstoftherapie (HBOT)
Hyperbare zuurstoftherapie (HBOT) houdt doorgaans in dat de luchtdruk gedurende 90 tot 120 minuten wordt verhoogd tot boven 1 absolute atmosfeer (ATA) – de luchtdruk op zeeniveau. Afhankelijk van de specifieke aandoening zijn vaak meerdere sessies nodig. De verhoogde luchtdruk verbetert de zuurstofvoorziening aan de cellen, wat op zijn beurt de proliferatie van stamcellen stimuleert en de genezingsprocessen bevordert die worden gemedieerd door bepaalde groeifactoren.
De toepassing van hyperbare zuurstoftherapie (HBOT) was oorspronkelijk gebaseerd op de wet van Boyle-Marriott, die stelt dat gasbellen afnemen bij toenemende druk, in combinatie met de voordelen van een hoog zuurstofgehalte in de weefsels. Er is een reeks aandoeningen bekend die baat hebben bij de hyperoxische toestand die door HBOT wordt opgewekt, waaronder necrotisch weefsel, stralingsletsel, trauma, brandwonden, compartimentsyndroom en gasgangreen, zoals vermeld door de Undersea and Hyperbaric Medical Society. HBOT heeft bovendien bewezen effectief te zijn als aanvullende behandeling bij verschillende modellen van ontstekings- of infectieziekten, zoals colitis en sepsis. Gezien de ontstekingsremmende en antioxiderende mechanismen biedt HBOT aanzienlijke mogelijkheden als therapeutische optie voor neurodegeneratieve ziekten.
Preklinische studies naar hyperbare zuurstoftherapie bij neurodegeneratieve ziekten: inzichten uit het 3×Tg-muismodel
Een van de opmerkelijke studiesHet onderzoek richtte zich op het 3×Tg-muismodel van de ziekte van Alzheimer (AD), dat het therapeutische potentieel van hyperbare zuurstoftherapie (HBOT) bij het verbeteren van cognitieve stoornissen aantoonde. Het onderzoek omvatte 17 maanden oude mannelijke 3×Tg-muizen, vergeleken met 14 maanden oude mannelijke C57BL/6-muizen als controlegroep. De studie toonde aan dat HBOT niet alleen de cognitieve functie verbeterde, maar ook de ontsteking, de plaquevorming en de Tau-fosforylering – een cruciaal proces dat verband houdt met de pathologie van AD – significant verminderde.
De beschermende effecten van hyperbare zuurstoftherapie (HBOT) werden toegeschreven aan een afname van neuro-inflammatie. Dit bleek uit de vermindering van microgliale proliferatie, astrogliose en de secretie van pro-inflammatoire cytokinen. Deze bevindingen benadrukken de dubbele rol van HBOT: het verbeteren van cognitieve prestaties en tegelijkertijd het verminderen van neuro-inflammatoire processen die gepaard gaan met de ziekte van Alzheimer.
Een ander preklinisch model maakte gebruik van 1-methyl-4-fenyl-1,2,3,6-tetrahydropyridine (MPTP)-muizen om de beschermende mechanismen van hyperbare zuurstoftherapie (HBOT) op neuronale functie en motorische vaardigheden te evalueren. De resultaten gaven aan dat HBOT bijdroeg aan een verbeterde motorische activiteit en grijpkracht bij deze muizen, wat correleerde met een toename van de signalering voor mitochondriale biogenese, met name door de activering van SIRT-1, PGC-1α en TFAM. Dit benadrukt de belangrijke rol van mitochondriale functie in de neuroprotectieve effecten van HBOT.
De mechanismen van hyperbare zuurstoftherapie bij neurodegeneratieve ziekten
Het onderliggende principe van hyperbare zuurstoftherapie (HBOT) voor neurodegeneratieve aandoeningen (NDD's) ligt in de relatie tussen een verminderde zuurstofvoorziening en de gevoeligheid voor neurodegeneratieve veranderingen. Hypoxia-inducible factor-1 (HIF-1) speelt een centrale rol als transcriptiefactor die cellulaire aanpassing aan een lage zuurstofspanning mogelijk maakt en is in verband gebracht met verschillende NDD's, waaronder de ziekte van Alzheimer, de ziekte van Parkinson, de ziekte van Huntington en amyotrofische laterale sclerose (ALS), waardoor het een cruciaal aangrijpingspunt voor medicijnen is.
Aangezien leeftijd een belangrijke risicofactor is voor diverse neurodegeneratieve aandoeningen, is het van essentieel belang om de impact van hyperbare zuurstoftherapie (HBOT) op de neurobiologie van veroudering te onderzoeken. Studies hebben aangetoond dat hyperbare zuurstoftherapie (HBOT) leeftijdsgebonden cognitieve stoornissen bij gezonde ouderen kan verbeteren.Bovendien vertoonden oudere patiënten met ernstige geheugenproblemen cognitieve verbeteringen en een verhoogde cerebrale bloeddoorstroming na blootstelling aan hyperbare zuurstoftherapie (HBOT).
1. Impact van hyperbare zuurstoftherapie (HBOT) op ontsteking en oxidatieve stress
Hyperbare zuurstoftherapie (HBOT) heeft aangetoond dat het neuro-inflammatie kan verlichten bij patiënten met ernstige hersenfunctiestoornissen. Het heeft het vermogen om pro-inflammatoire cytokinen (zoals IL-1β, IL-12, TNFα en IFNγ) te downreguleren en anti-inflammatoire cytokinen (zoals IL-10) te upreguleren. Sommige onderzoekers suggereren dat reactieve zuurstofsoorten (ROS) die door HBOT worden gegenereerd, verschillende gunstige effecten van de therapie bewerkstelligen. Naast de drukafhankelijke werking om de luchtbellen te verminderen en het bereiken van een hoge zuurstofverzadiging in het weefsel, zijn de positieve resultaten van HBOT dus mede afhankelijk van de fysiologische rollen van de geproduceerde ROS.
2. Effecten van hyperbare zuurstoftherapie op apoptose en neuroprotectie
Onderzoek heeft aangetoond dat hyperbare zuurstoftherapie (HBOT) de fosforylering van p38 mitogeen-geactiveerd proteïnekinase (MAPK) in de hippocampus kan verminderen, wat vervolgens de cognitie verbetert en de schade aan de hippocampus vermindert. Zowel HBOT als HBOT in combinatie met Ginkgo biloba-extract bleek de expressie van Bax en de activiteit van caspase-9/3 te verlagen, wat resulteerde in een afname van de apoptosesnelheid in knaagdiermodellen geïnduceerd door aβ25-35. Bovendien toonde een andere studie aan dat HBOT-voorbehandeling tolerantie induceerde tegen cerebrale ischemie, met mechanismen die een verhoogde SIRT1-expressie omvatten, samen met verhoogde B-cellymfoom 2 (Bcl-2)-niveaus en een verlaagde activiteit van caspase-3, wat de neuroprotectieve en anti-apoptotische eigenschappen van HBOT onderstreept.
3. Invloed van HBOT op de bloedsomloop enNeurogenese
Blootstelling van proefpersonen aan hyperbare zuurstoftherapie (HBOT) is in verband gebracht met diverse effecten op het craniale vaatstelsel, waaronder het verbeteren van de doorlaatbaarheid van de bloed-hersenbarrière, het bevorderen van angiogenese en het verminderen van oedeem. Naast het verhogen van de zuurstofvoorziening aan de weefsels, heeft HBOT ook andere effecten.bevordert de vorming van bloedvatendoor transcriptiefactoren zoals vasculaire endotheliale groeifactor te activeren en door de proliferatie van neurale stamcellen te stimuleren.
4. Epigenetische effecten van HBOT
Uit onderzoek is gebleken dat blootstelling van menselijke microvasculaire endotheelcellen (HMEC-1) aan hyperbare zuurstof de expressie van 8.101 genen significant beïnvloedt, zowel door verhoogde als verlaagde expressie, wat wijst op een toename van de genexpressie die geassocieerd is met antioxidantresponsroutes.
Conclusie
Het gebruik van hyperbare zuurstoftherapie (HBOT) heeft in de loop der tijd aanzienlijke vooruitgang geboekt, waarmee de beschikbaarheid, betrouwbaarheid en veiligheid ervan in de klinische praktijk zijn bewezen. Hoewel HBOT is onderzocht als een off-label behandeling voor neurodegeneratieve aandoeningen en er enig onderzoek is verricht, blijft er een dringende behoefte aan gedegen onderzoek om de HBOT-praktijk bij de behandeling van deze aandoeningen te standaardiseren. Verder onderzoek is essentieel om de optimale behandelingsfrequentie te bepalen en de mate van gunstige effecten voor patiënten te beoordelen.
Samenvattend biedt de wisselwerking tussen hyperbare zuurstoftherapie en neurodegeneratieve ziekten veelbelovende therapeutische mogelijkheden, die verder onderzoek en validatie in klinische settings rechtvaardigen.
Geplaatst op: 16 mei 2025

