In de moderne geneeskunde zijn antibiotica een van de belangrijkste doorbraken gebleken, met een drastische daling van het aantal gevallen en de sterftecijfers als gevolg van microbiële infecties. Hun vermogen om de klinische uitkomsten van bacteriële infecties te beïnvloeden, heeft de levensverwachting van talloze patiënten verlengd. Antibiotica zijn essentieel bij complexe medische ingrepen, zoals operaties, het plaatsen van implantaten, transplantaties en chemotherapie. De opkomst van antibioticaresistente pathogenen baart echter steeds meer zorgen, omdat de effectiviteit van deze geneesmiddelen in de loop der tijd afneemt. Resistentie tegen antibiotica is gedocumenteerd bij alle categorieën antibiotica, als gevolg van microbiële mutaties. De selectiedruk die door antimicrobiële geneesmiddelen wordt uitgeoefend, heeft bijgedragen aan de opkomst van resistente stammen, wat een aanzienlijke uitdaging vormt voor de wereldwijde gezondheid.
Om het nijpende probleem van antimicrobiële resistentie aan te pakken, is het essentieel om effectief infectiepreventiebeleid te implementeren dat de verspreiding van resistente pathogenen tegengaat en tegelijkertijd het antibioticagebruik vermindert. Bovendien is er een dringende behoefte aan alternatieve behandelmethoden. Hyperbare zuurstoftherapie (HBOT) is in dit kader naar voren gekomen als een veelbelovende behandelingsmethode. Hierbij wordt gedurende een bepaalde tijd 100% zuurstof onder specifieke druk ingeademd. HBOT kan worden ingezet als primaire of aanvullende behandeling voor infecties en biedt mogelijk nieuwe hoop bij de behandeling van acute infecties veroorzaakt door antibioticaresistente pathogenen.
Deze therapie wordt steeds vaker toegepast als primaire of alternatieve behandeling voor diverse aandoeningen, waaronder ontstekingen, koolmonoxidevergiftiging, chronische wonden, ischemische ziekten en infecties. De klinische toepassingen van hyperbare zuurstoftherapie (HBOT) bij de behandeling van infecties zijn aanzienlijk en bieden patiënten onschatbare voordelen.

Klinische toepassingen van hyperbare zuurstoftherapie bij infecties
Het huidige bewijsmateriaal ondersteunt overtuigend de toepassing van hyperbare zuurstoftherapie (HBOT), zowel als zelfstandige behandeling als in combinatie met andere therapieën, met aanzienlijke voordelen voor geïnfecteerde patiënten. Tijdens HBOT kan de arteriële zuurstofdruk oplopen tot 2000 mmHg, en de resulterende hoge drukgradiënt tussen zuurstof en weefsel kan de zuurstofconcentratie in het weefsel verhogen tot 500 mmHg. Dergelijke effecten zijn met name waardevol voor het bevorderen van de genezing van ontstekingsreacties en verstoringen van de microcirculatie die worden waargenomen in ischemische omgevingen, evenals voor de behandeling van compartimentsyndroom.
Hyperbare zuurstoftherapie (HBOT) kan ook invloed hebben op aandoeningen die afhankelijk zijn van het immuunsysteem. Onderzoek wijst uit dat HBOT auto-immuunsyndromen en door antigenen geïnduceerde immuunreacties kan onderdrukken, waardoor de transplantatietolerantie behouden blijft door de circulatie van lymfocyten en leukocyten te verminderen en tegelijkertijd de immuunreacties te moduleren. Daarnaast kan HBOTondersteunt genezingBij chronische huidlaesies stimuleert deze therapie de angiogenese, een cruciaal proces voor een beter herstel. Daarnaast bevordert deze therapie de vorming van een collageenmatrix, een essentiële fase in wondgenezing.
Bij bepaalde infecties, met name diepe en moeilijk te behandelen infecties zoals necrotiserende fasciitis, osteomyelitis, chronische weke-deleninfecties en infectieuze endocarditis, moet speciale aandacht worden besteed. Een van de meest voorkomende klinische toepassingen van hyperbare zuurstoftherapie (HBOT) is bij huid- en weke-deleninfecties en osteomyelitis die gepaard gaan met een laag zuurstofgehalte en die vaak worden veroorzaakt door anaërobe of resistente bacteriën.
1. Diabetische voetinfecties
Diabetische voetZweren zijn een veelvoorkomende complicatie bij diabetespatiënten en treffen tot 25% van deze populatie. Infecties ontstaan vaak in deze zweren (goed voor 40%-80% van de gevallen) en leiden tot verhoogde morbiditeit en mortaliteit. Diabetische voetinfecties (DFI's) bestaan meestal uit polymicrobiële infecties met een verscheidenheid aan anaërobe bacteriële pathogenen. Verschillende factoren, waaronder defecten in de fibroblastfunctie, problemen met de collageenvorming, cellulaire immuunmechanismen en de fagocytfunctie, kunnen de wondgenezing bij diabetespatiënten belemmeren. Verschillende studies hebben aangetoond dat een verminderde zuurstofvoorziening van de huid een belangrijke risicofactor is voor amputaties als gevolg van DFI's.
Als een van de huidige behandelingsopties voor DFIHyperbare zuurstoftherapie (HBOT) blijkt de genezing van diabetische voetulcera aanzienlijk te versnellen, waardoor de noodzaak voor amputaties en complexe chirurgische ingrepen afneemt. Het minimaliseert niet alleen de noodzaak voor arbeidsintensieve procedures, zoals huidtransplantaties en lapjesplastiek, maar is ook goedkoper en kent minimale bijwerkingen in vergelijking met chirurgische ingrepen. Een studie van Chen et al. toonde aan dat meer dan 10 HBOT-sessies leidden tot een verbetering van 78,3% in de wondgenezing bij diabetische patiënten.
2. Necrotiserende weke-deleninfecties
Necrotiserende weke-deleninfecties (NSTI's) zijn vaak polymicrobieel, meestal veroorzaakt door een combinatie van aerobe en anaerobe bacteriële pathogenen, en gaan vaak gepaard met gasvorming. Hoewel NSTI's relatief zeldzaam zijn, hebben ze een hoge mortaliteit vanwege hun snelle progressie. Tijdige en adequate diagnose en behandeling zijn essentieel voor een gunstige uitkomst, en hyperbare zuurstoftherapie (HBOT) wordt aanbevolen als aanvullende methode voor de behandeling van NSTI's. Hoewel er nog steeds discussie bestaat over het gebruik van HBOT bij NSTI's vanwege het gebrek aan prospectieve, gecontroleerde studies,Er zijn aanwijzingen dat dit verband kan houden met verbeterde overlevingskansen en orgaanbehoud bij NSTI-patiënten.Een retrospectieve studie toonde een significante daling van de sterftecijfers aan bij patiënten met necrotiserende weke-tissue-infecties die hyperbare zuurstoftherapie (HBOT) kregen.
1.3 Infecties op de operatieplaats
Postoperatieve wondinfecties (SSI's) kunnen worden geclassificeerd op basis van de anatomische locatie van de infectie en kunnen worden veroorzaakt door verschillende pathogenen, waaronder zowel aerobe als anaerobe bacteriën. Ondanks vooruitgang in infectiepreventiemaatregelen, zoals sterilisatietechnieken, het gebruik van profylactische antibiotica en verbeteringen in chirurgische procedures, blijven SSI's een hardnekkige complicatie.
Een belangrijk overzichtsartikel heeft de effectiviteit van hyperbare zuurstoftherapie (HBOT) bij het voorkomen van diepe wondinfecties na neuromusculaire scoliosechirurgie onderzocht. Preoperatieve HBOT kan de incidentie van wondinfecties aanzienlijk verminderen en de wondgenezing bevorderen. Deze niet-invasieve therapie creëert een omgeving waarin het zuurstofgehalte in het wondweefsel verhoogd is, wat in verband wordt gebracht met de oxidatieve werking tegen pathogenen. Bovendien pakt het de verlaagde bloed- en zuurstofniveaus aan die bijdragen aan het ontstaan van wondinfecties. Naast andere infectiepreventiestrategieën wordt HBOT met name aanbevolen voor operaties waarbij het weefsel schoon maar toch gecontamineerd kan zijn, zoals colorectale ingrepen.
1.4 Brandwonden
Brandwonden zijn verwondingen veroorzaakt door extreme hitte, elektrische stroom, chemicaliën of straling en kunnen een hoge morbiditeit en mortaliteit tot gevolg hebben. Hyperbare zuurstoftherapie (HBOT) is gunstig bij de behandeling van brandwonden doordat het de zuurstofniveaus in beschadigd weefsel verhoogt. Hoewel dier- en klinische studies wisselende resultaten laten zien met betrekking tot de effectiviteit van HBOT.de effectiviteit van hyperbare zuurstoftherapie (HBOT) bij de behandeling van brandwondenEen onderzoek onder 125 brandwondenpatiënten toonde aan dat hyperbare zuurstoftherapie (HBOT) geen significant effect had op de sterftecijfers of het aantal uitgevoerde operaties, maar wel de gemiddelde genezingstijd verkortte (19,7 dagen vergeleken met 43,8 dagen). Integratie van HBOT in een alomvattend brandwondenmanagement zou sepsis bij brandwondenpatiënten effectief kunnen bestrijden, wat zou leiden tot kortere genezingstijden en een verminderde vochtbehoefte. Verder uitgebreid prospectief onderzoek is echter nodig om de rol van HBOT bij de behandeling van uitgebreide brandwonden te bevestigen.
1.5 Osteomyelitis
Osteomyelitis is een infectie van het bot of beenmerg, vaak veroorzaakt door bacteriële pathogenen. De behandeling van osteomyelitis kan lastig zijn vanwege de relatief slechte bloedtoevoer naar de botten en de beperkte penetratie van antibiotica in het beenmerg. Chronische osteomyelitis wordt gekenmerkt door aanhoudende pathogenen, milde ontsteking en de vorming van necrotisch botweefsel. Refractaire osteomyelitis verwijst naar chronische botinfecties die aanhouden of terugkeren ondanks een adequate behandeling.
Het is aangetoond dat hyperbare zuurstoftherapie (HBOT) de zuurstofniveaus in het geïnfecteerde botweefsel aanzienlijk verbetert. Talrijke casusreeksen en cohortstudies tonen aan dat HBOT de klinische resultaten voor patiënten met osteomyelitis verbetert. Het lijkt te werken via verschillende mechanismen, waaronder het stimuleren van de metabolische activiteit, het onderdrukken van bacteriële pathogenen, het versterken van de werking van antibiotica, het minimaliseren van ontstekingen en het bevorderen van genezing.processen. Na HBOT vertoont 60% tot 85% van de patiënten met chronische, refractaire osteomyelitis tekenen van infectieonderdrukking.
1.6 Schimmelinfecties
Wereldwijd lijden meer dan drie miljoen mensen aan chronische of invasieve schimmelinfecties, met jaarlijks meer dan 600.000 sterfgevallen tot gevolg. De behandelresultaten van schimmelinfecties worden vaak beïnvloed door factoren zoals een veranderde immuunstatus, onderliggende ziekten en de virulentie van de ziekteverwekker. Hyperbare zuurstoftherapie (HBOT) wordt een aantrekkelijke therapeutische optie bij ernstige schimmelinfecties vanwege de veiligheid en het niet-invasieve karakter. Studies tonen aan dat HBOT effectief kan zijn tegen schimmelpathogenen zoals Aspergillus en Mycobacterium tuberculosis.
Hyperbare zuurstoftherapie (HBOT) bevordert antischimmelwerking door de biofilmvorming van Aspergillus te remmen, waarbij een verhoogde efficiëntie wordt waargenomen bij stammen die geen superoxide dismutase (SOD)-genen bezitten. De hypoxische omstandigheden tijdens schimmelinfecties vormen een uitdaging voor de toediening van antischimmelmedicijnen, waardoor de verhoogde zuurstofniveaus door HBOT een potentieel gunstige interventie kunnen zijn, hoewel verder onderzoek nodig is.
De antimicrobiële eigenschappen van HBOT
De hyperoxische omgeving die door HBOT wordt gecreëerd, initieert fysiologische en biochemische veranderingen die antibacteriële eigenschappen stimuleren, waardoor het een effectieve aanvullende therapie is bij infecties. HBOT vertoont opmerkelijke effecten tegen aerobe bacteriën en voornamelijk anaerobe bacteriën via mechanismen zoals directe bacteriedodende activiteit, versterking van immuunreacties en synergetische effecten met specifieke antimicrobiële middelen.
2.1 Directe antibacteriële effecten van HBOT
Het directe antibacteriële effect van hyperbare zuurstoftherapie (HBOT) wordt grotendeels toegeschreven aan de aanmaak van reactieve zuurstofsoorten (ROS), waaronder superoxide-anionen, waterstofperoxide, hydroxylradicalen en hydroxylionen – die allemaal ontstaan tijdens het cellulaire metabolisme.
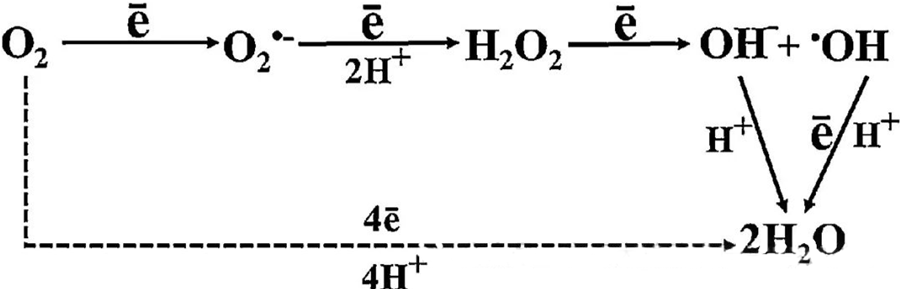
De interactie tussen O₂ en cellulaire componenten is essentieel voor het begrijpen van de vorming van ROS in cellen. Onder bepaalde omstandigheden, oxidatieve stress genoemd, raakt het evenwicht tussen de vorming en afbraak van ROS verstoord, wat leidt tot verhoogde ROS-niveaus in cellen. De productie van superoxide (O₂⁻) wordt gekatalyseerd door superoxide dismutase, dat O₂⁻ vervolgens omzet in waterstofperoxide (H₂O₂). Deze omzetting wordt verder versterkt door de Fenton-reactie, die Fe²⁺ oxideert tot hydroxylradicalen (·OH) en Fe³⁺, waarmee een schadelijke redoxsequentie van ROS-vorming en cellulaire schade wordt geïnitieerd.
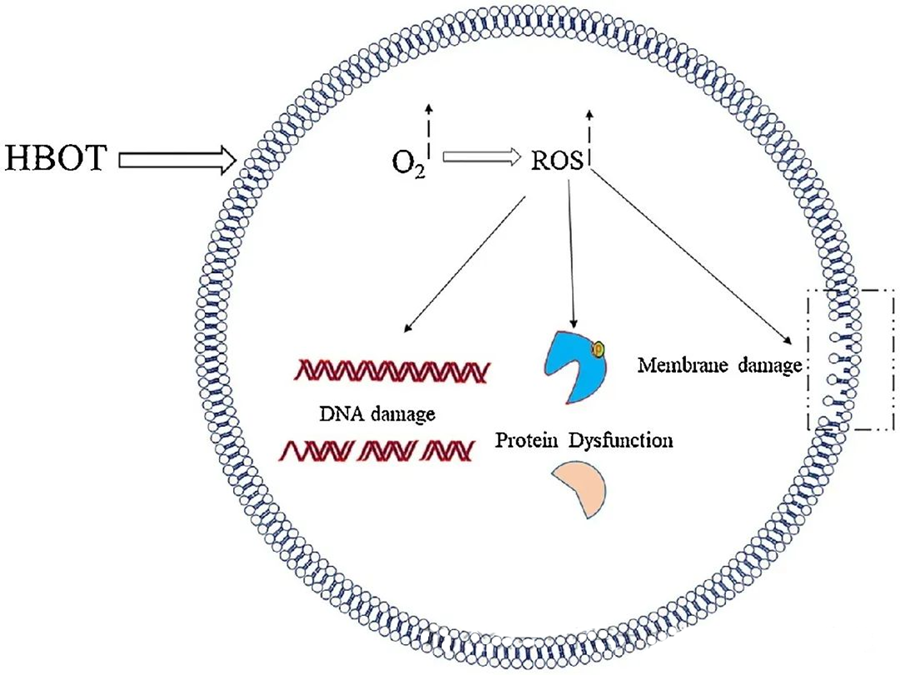
De toxische effecten van ROS richten zich op cruciale cellulaire componenten zoals DNA, RNA, eiwitten en lipiden. Met name DNA is een primair doelwit van H₂O₂-gemedieerde cytotoxiciteit, omdat het de deoxyribosestructuren verstoort en de basensamenstelling beschadigt. De fysieke schade die door ROS wordt veroorzaakt, strekt zich uit tot de helixstructuur van DNA, mogelijk als gevolg van lipideperoxidatie die door ROS wordt getriggerd. Dit onderstreept de nadelige gevolgen van verhoogde ROS-niveaus in biologische systemen.
Antimicrobiële werking van ROS
Reactieve zuurstofsoorten (ROS) spelen een essentiële rol bij het remmen van microbiële groei, zoals aangetoond door de door hyperbare zuurstoftherapie (HBOT) geïnduceerde ROS-productie. De toxische effecten van ROS richten zich rechtstreeks op cellulaire bestanddelen zoals DNA, eiwitten en lipiden. Hoge concentraties actieve zuurstofsoorten kunnen lipiden direct beschadigen, wat leidt tot lipidenperoxidatie. Dit proces tast de integriteit van celmembranen aan en daarmee de functionaliteit van membraangebonden receptoren en eiwitten.
Bovendien ondergaan eiwitten, die ook belangrijke moleculaire doelwitten zijn van ROS, specifieke oxidatieve modificaties op verschillende aminozuurresiduen zoals cysteïne, methionine, tyrosine, fenylalanine en tryptofaan. Zo is bijvoorbeeld aangetoond dat hyperbare zuurstoftherapie (HBOT) oxidatieve veranderingen teweegbrengt in verschillende eiwitten in E. coli, waaronder elongatiefactor G en DnaK, waardoor hun cellulaire functies worden beïnvloed.
Immuniteitsversterking door middel van hyperbare zuurstoftherapie (HBOT).
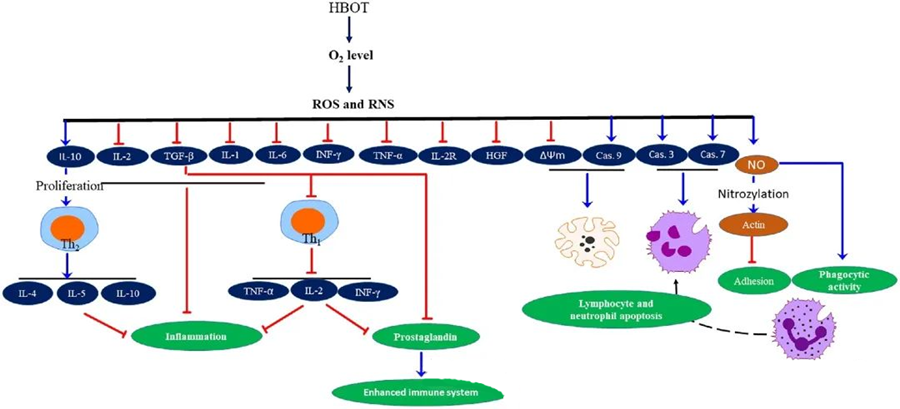
De ontstekingsremmende eigenschappen van hyperbare zuurstoftherapie (HBOT).Dit is gedocumenteerd en blijkt cruciaal te zijn voor het verminderen van weefselschade en het onderdrukken van de voortgang van infecties. Hyperbare zuurstoftherapie (HBOT) heeft een significante invloed op de expressie van cytokinen en andere ontstekingsregulatoren, waardoor de immuunrespons wordt beïnvloed. Verschillende experimentele systemen observeerden differentiële veranderingen in genexpressie en eiwitproductie na HBOT, die de groeifactoren en cytokinen ofwel op- ofwel neerreguleren.
Tijdens de hyperbare zuurstoftherapie (HBOT) zorgt een verhoogd zuurstofgehalte voor een reeks cellulaire reacties, zoals het onderdrukken van de afgifte van pro-inflammatoire mediatoren en het bevorderen van apoptose van lymfocyten en neutrofielen. Gezamenlijk versterken deze acties de antimicrobiële mechanismen van het immuunsysteem, waardoor de genezing van infecties wordt vergemakkelijkt.
Bovendien suggereren studies dat verhoogde zuurstofniveaus tijdens hyperbare zuurstoftherapie (HBOT) de expressie van pro-inflammatoire cytokinen kunnen verminderen, waaronder interferon-gamma (IFN-γ), interleukine-1 (IL-1) en interleukine-6 (IL-6). Deze veranderingen omvatten ook een verlaging van de verhouding CD4:CD8 T-cellen en de modulatie van andere oplosbare receptoren, wat uiteindelijk leidt tot een verhoging van de interleukine-10 (IL-10)-spiegel. Dit is cruciaal voor het tegengaan van ontstekingen en het bevorderen van genezing.
De antimicrobiële werking van hyperbare zuurstoftherapie (HBOT) is verweven met complexe biologische mechanismen. Zowel superoxide als verhoogde druk blijken de door HBOT geïnduceerde antibacteriële activiteit en neutrofielapoptose op inconsistente wijze te bevorderen. Na HBOT verhoogt een aanzienlijke stijging van het zuurstofgehalte het bacteriedodende vermogen van neutrofielen, een essentieel onderdeel van de immuunrespons. Bovendien onderdrukt HBOT de adhesie van neutrofielen, die wordt gemedieerd door de interactie van β-integrinen op neutrofielen met intercellulaire adhesiemoleculen (ICAM) op endotheelcellen. HBOT remt de activiteit van neutrofiel β-2-integrine (Mac-1, CD11b/CD18) via een stikstofmonoxide (NO)-gemedieerd proces, wat bijdraagt aan de migratie van neutrofielen naar de infectiehaard.
De precieze herstructurering van het cytoskelet is noodzakelijk voor neutrofielen om pathogenen effectief te fagocyteren. Er is aangetoond dat S-nitrosylering van actine de actinepolymerisatie stimuleert, wat mogelijk de fagocytische activiteit van neutrofielen na hyperbare zuurstoftherapie (HBOT) bevordert. Bovendien bevordert HBOT apoptose in humane T-cellijnen via mitochondriale routes, waarbij versnelde lymfocytendood na HBOT is waargenomen. Het blokkeren van caspase-9 – zonder caspase-8 te beïnvloeden – heeft de immunomodulerende effecten van HBOT aangetoond.
De synergetische effecten van hyperbare zuurstoftherapie (HBOT) in combinatie met antimicrobiële middelen.
In de klinische praktijk wordt hyperbare zuurstoftherapie (HBOT) vaak gebruikt in combinatie met antibiotica om infecties effectief te bestrijden. De hyperoxische toestand die tijdens HBOT wordt bereikt, kan de werkzaamheid van bepaalde antibiotica beïnvloeden. Onderzoek suggereert dat specifieke bacteriedodende geneesmiddelen, zoals β-lactamantibiotica, fluoroquinolonen en aminoglycosiden, niet alleen via inherente mechanismen werken, maar ook gedeeltelijk afhankelijk zijn van het aerobe metabolisme van bacteriën. Daarom zijn de aanwezigheid van zuurstof en de metabolische kenmerken van pathogenen cruciaal bij het beoordelen van de therapeutische effecten van antibiotica.
Uit significant onderzoek is gebleken dat lage zuurstofniveaus de resistentie van Pseudomonas aeruginosa tegen piperacillin/tazobactam kunnen verhogen en dat een zuurstofarme omgeving ook bijdraagt aan de verhoogde resistentie van Enterobacter cloacae tegen azithromycine. Omgekeerd kunnen bepaalde hypoxische omstandigheden de gevoeligheid van bacteriën voor tetracycline-antibiotica verhogen. Hyperbare zuurstoftherapie (HBOT) is een effectieve aanvullende therapeutische methode die het aerobe metabolisme stimuleert en de zuurstofvoorziening van hypoxisch geïnfecteerd weefsel verbetert, waardoor de gevoeligheid van pathogenen voor antibiotica toeneemt.
In preklinische studies verminderde de combinatie van hyperbare zuurstoftherapie (HBOT) – tweemaal daags gedurende 8 uur bij 280 kPa – met tobramycine (20 mg/kg/dag) de bacteriële belasting bij infectieuze endocarditis veroorzaakt door Staphylococcus aureus aanzienlijk. Dit toont het potentieel van HBOT als aanvullende behandeling aan. Verder onderzoek heeft uitgewezen dat HBOT bij 37°C en een druk van 3 ATA gedurende 5 uur de werking van imipenem tegen macrofaag-geïnfecteerde Pseudomonas aeruginosa aanzienlijk versterkte. Bovendien bleek de gecombineerde behandeling met HBOT en cefazoline effectiever te zijn bij de behandeling van osteomyelitis veroorzaakt door Staphylococcus aureus in diermodellen dan cefazoline alleen.
Hyperbare zuurstoftherapie (HBOT) verhoogt ook de bacteriedodende werking van ciprofloxacine tegen Pseudomonas aeruginosa-biofilms aanzienlijk, met name na 90 minuten blootstelling. Deze versterking wordt toegeschreven aan de vorming van endogene reactieve zuurstofsoorten (ROS) en vertoont een verhoogde gevoeligheid bij peroxidase-deficiënte mutanten.
In modellen van pleuritis veroorzaakt door methicilline-resistente Staphylococcus aureus (MRSA), toonde het gecombineerde effect van vancomycine, teicoplanine en linezolid met hyperbare zuurstoftherapie (HBOT) een significant verhoogde werkzaamheid tegen MRSA. Metronidazol, een antibioticum dat veelvuldig wordt gebruikt bij de behandeling van ernstige anaerobe en polymicrobiële infecties zoals diabetische voetinfecties (DFI's) en chirurgische wondinfecties (SSI's), heeft een hogere antimicrobiële werkzaamheid aangetoond onder anaerobe omstandigheden. Toekomstig onderzoek is nodig om de synergetische antibacteriële effecten van HBOT in combinatie met metronidazol te onderzoeken, zowel in vivo als in vitro.
De antimicrobiële werkzaamheid van hyperbare zuurstoftherapie (HBOT) op resistente bacteriën.
Door de evolutie en verspreiding van resistente stammen verliezen traditionele antibiotica na verloop van tijd vaak hun werkzaamheid. Hyperbare zuurstoftherapie (HBOT) kan daarom essentieel blijken bij de behandeling en preventie van infecties veroorzaakt door multiresistente pathogenen, en kan een cruciale strategie vormen wanneer antibioticabehandelingen falen. Talrijke studies hebben de significante bacteriedodende effecten van HBOT op klinisch relevante resistente bacteriën aangetoond. Zo verminderde een HBOT-sessie van 90 minuten bij 2 ATM de groei van MRSA aanzienlijk. Bovendien heeft HBOT in ratio-modellen de antibacteriële werking van verschillende antibiotica tegen MRSA-infecties versterkt. Rapporten hebben bevestigd dat HBOT effectief is bij de behandeling van osteomyelitis veroorzaakt door OXA-48-producerende Klebsiella pneumoniae zonder dat aanvullende antibiotica nodig zijn.
Samenvattend is hyperbare zuurstoftherapie een veelzijdige aanpak voor infectiebestrijding, die de immuunrespons versterkt en tegelijkertijd de werkzaamheid van bestaande antimicrobiële middelen vergroot. Dankzij uitgebreid onderzoek en ontwikkeling heeft deze therapie de potentie om de effecten van antibioticaresistentie te verminderen en biedt daarmee hoop in de voortdurende strijd tegen bacteriële infecties.
Geplaatst op: 28 februari 2025

